Aktuální genetika
Multimediální učebnice lékařské biologie, genetiky a genomikyNutrigenomika
Velmi dynamický až překotný vývoj posledních let v oblasti genetiky a příbuzných oborů na jedné straně otevírá dříve nemyslitelné perspektivy základního i klinického výzkumu, na druhé straně s sebou nese riziko příliš jednostranného, "genocentrického" nazírání patogeneze lidských onemocnění a biologických pochodů obecně. Pro nutnost komplexnějšího pohledu přitom svědčí i aktuální nástup pandemie obezity a ostatních tzv. civilizačních chorob. Ten nastal v relativně krátkém období, ve kterém nelze předpokládat významnější změny lidského genomu na globální úrovni. Příčinu lze tedy pravděpodobně hledat v posunu výslednice interakce genom-prostředí, kde prostředím chápeme především životní styl a jeho dramatickou proměnu v průběhu minulého století, zahrnující kvantitativní i kvalitativní posuny v rámci fyzické aktivity, stresu a v neposlední řadě diety.
Empiricky je dobře známo, že jak množství, tak složení stravy významně ovlivňuje nástup, průběh i léčbu prakticky všech onemocnění. Na rozdíl od cíleně podávaných definovaných dávek farmak o známém složení a většinou i se známými cílovými strukturami a mechanismy jejich účinku, potravou dlouhodobě přijímáme heterogenní směs mnohdy biologicky aktivních látek. Některé z nich jsou přímými ligandy receptorů ovlivňujících transkripci řady genů (1). Navíc se ukazuje, že nezanedbatelný je již vliv diety matky v průběhu těhotenství, která podobně jako např. kouření (2) epigenetickým mechanismem "metabolického programování" nastavuje homeostatické systémy vyvíjejícího se plodu (3).
Díky rozvoji metod molekulární genetiky a bioinformatiky je možné nyní koncipovat integrativní přístupy v rámci studia tak prevalentních chorob, jako je např. metabolický syndrom a zahrnout tak původní protikladné principy vyjádřené v dichotomii "nature vs. nurture" do jednotného paradigmatu nového oboru, nutriční genomiky (angl. nutritional genomics, nutrigenomics).
Nutriční genomika a její definice
Ačkoli je obecně přijímán fakt, že běžná strava obsahuje řadu bioaktivních látek, které mohou prostřednictvím receptorů spouštět či modulovat transkripci cílových genů (1) či přímo působit změnu chromatinové struktury (4), není tato skutečnost často reflektována v designu a interpretaci genetických a epidemiologických studií. Zjednodušeně řečeno, studie sledující důsledky podávání určitého typu diety často pomíjejí možný efekt genetické variability uvnitř zkoumané kohorty, naproti tomu genetické studie hodnotící vliv kandidátního polymorfismu na sledovaný znak (krevní tlak, obezitu) nezahrnují odlišnou expozici složkám diety, která může zásadně ovlivnit výslednou asociaci. Tuto mezeru chce právě nutriční genetika vyplnit. V určité paralele k farmakogenomice tedy nutriční genomika zkoumá, jak chemické látky obsažené v běžné v potravě ovlivňují rovnováhu mezi zdravím a nemocí skrze interakci s genomem jedince. Vychází přitom z několika základních předpokladů (5):
- Látky obsažené v potravě (mikro- i makronutrienty) působí přímo či nepřímo na lidský genom a mění tak jeho strukturu či genovou expresi.
- Za určitých okolností může být dieta u některých jedinců významným rizikovým faktorem vzniku řady chorob.
- Některé z cílových genů látek obsažených v potravě hrají pravděpodobně roli v nástupu, incidenci, průběhu a závažnosti některých chronických chorob.
- Míra vlivu diety na rovnováhu mezi stavem zdraví a nemoci může záviset na konkrétní genetické výbavě jednotlivce.
- Nutriční intervence založená na znalosti jak konkrétního nutričního stavu a potřeb, tak genotypu (individualizovaná výživa) může být užita k prevenci, zmírnění nebo léčení chronických nemocí.
Nástroje nutriční genomiky
Vznik samostatného oboru nutriční genomiky byl podmíněn technologickými možnostmi analýzy vlivu přijímané stravy na úrovni celého genomu, podobně jako tomu bylo u příbuzných oborů farmakogenomiky a funkční genomiky. Jedním z významných nástrojů nutriční genomiky tak je expresní profilování genů - transkriptomu, např. pomocí expresních cRNA nebo cDNA čipů, analogické postupy byly vyvinuty pro sledování exprese na úrovni proteinů (proteomu - především dvojrozměrná elektroforéza a různé formy hmotnostní spektrometrie) a metabolitů (metabolomu). Profily exprese genů, proteinů a metabolitů v odpovědi na danou složku stravy nebo nutriční režim jsou zde vnímány jako tzv. "dietní signatury", které jsou dále zkoumány na úrovni specifických buněk, tkání i celých organismů za účelem porozumění vlivu výživy na homeostázu. Detailní aspekty této problematiky přesahují rámec tohoto článku, proto odkazujeme na recentní přehledovou literaturu k tématu (6, 7). Aby bylo však možné provádět statisticky robustní experimenty, jejichž výsledky budou reprodukovatelné a zevšeobecnitelné, je třeba vyřešit otázky týkající se dvou zásadních oblastí, se kterými se genetická epidemiologie v rámci nutriční genomiky prozatím ne zcela dokázala vyrovnat. Jedná se o naši schopnost analýzy obou složek nutri-genetické interakce, tedy jak detailní určení fyzikálně-chemických charakteristik stravy, tak cílových struktur a polymorfismů v genomu.
Vyjma vzácných případů, jako jsou relativní populační izoláty, u kterých je omezena genetická variabilita, je u lidí detailní analýza samotné genetické komponenty komplexních metabolických onemocnění velmi obtížná už bez zahrnutí její interakce s prostředím (tj. dietou v případě nutriční genomiky). Faktory znesnadňující genetickou analýzu zahrnují genetickou heterogenitu obecné lidské populace či měnlivou penetranci komplexních znaků (7). Příkladem geneticky relativně izolované populace je např. náboženská sekta Huteritů. Ta původně vznikla v tyrolských Alpách v 16. století. Ve dvou následujících stoletích se, již na území Ruska, rozrostla ze 120 na více než 1000 členů. V 70. letech 19. století 900 členů této sekty emigrovalo na dnešní území Jižní Dakoty (USA). V dnešní době jich zde žije na více než 350 komunitních farmách (koloniích) přibližně 35000. Kromě toho, že lze pomocí genealogické analýzy identifikovat 90 společných předků všech dnešních Huteritů, je obrovskou výhodou uniformní životní styl včetně společného stravování všech členů kolonie v komunitních jídelnách, kde jsou připravována jídla podle tradičních receptur (8). Přes zmíněné výhody populačních izolátů však stále zůstává otevřená otázka významu a uplatnitelnosti takto zjištěných dat a vztahů v obecné lidské populaci.
V současné době je zásadním přístupem v základním výzkumu interakcí mezi geny a prostředím využívání geneticky definovaných savčích modelů, především inbredních kmenů myši a potkana (např. 9). Zřejmé výhody tohoto přístupu zahrnují možnosti cíleného křížení a modifikace genotypu, standardizace podmínek prostředí či opakovatelnost experimentů. Pomocí metod komparativní genomiky je pak možné integrovat poznatky relevantní z hlediska interakce diety s genetickou výbavou jedince ze studií lidských s experimentálními (obr.1) a následovně pak vytvářet "mapy" genů, jejichž varianty se podílí na odlišné odezvě vůči jednotlivým složkám diety, stejně jako jsou k dispozici mapy kandidátních genů např. pro obezitu (10) nebo hypertriglyceridémii (11). Při dostatečně reprezentativním pokrytí genomů markery a zjištění většího množství polymorfismů, ať už se bude jednat o polymorfismy jednotlivých nukleotidů (angl. single nucleotide polymorphisms - SNP) nebo haplotypy, což si kladou za cíl mezinárodní konzorcia (12), bude položen základ pro predikci řady nutrigenomických interakcí např. pomocí specializované formy DNA čipu, kterým se bude najednou testovat několik tisíc polymorfismů, u kterých je prokázána spojitost definované varianty s nežádoucí reakcí na přítomnost nebo množství určité látky v potravě. I před dosažením takového velkorysého cíle však bude pravděpodobně možné identifikovat nové biologické markery, použitelné jako časné indikátory nežádoucího nebo žádoucího účinku diety. Tuto informaci bude možné využít jak v prevenci, tak v terapii onemocnění, kde nutrigenetické interakce hrají podstatnou úlohu.
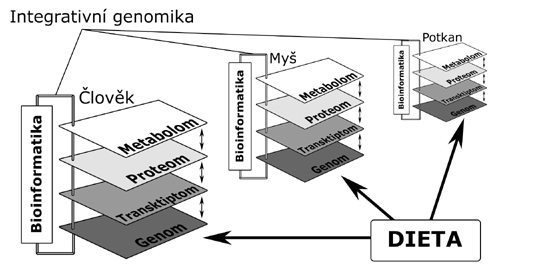
Nutrigenetické interakce
Klasickým příkladem nutrigenetické interakce vedoucí k manifestaci klinicky zřetelného stavu je perzistující tolerance laktózy v dospělém věku. Bodová mutace C13910T, ke které došlo přibližně před 9000 lety v severoevropské populaci, způsobila přetrvávající expresi genu kódujícího hydrolázu laktázy a zabránila tak přirozenému vyhasínání funkce tohoto enzymu v dospělosti a nástupu fyziologické hypolaktázie (13). Kromě takovéto "statické" interakce může docházet i k interakcím "dynamickým", tedy rozdílné odpovědi na změnu dietního režimu dle genetické výbavy jedince. Při sledování mužské kohorty z české studie MONICA, u které došlo v období 1988-1996 k výrazné změně složení stravy, bylo zjištěno, že pouze u nositelů alely CC-204 genu cholesterol-7alfa-hydroxylázy (CYP-7A1) došlo k redukci hladin cholesterolu, nositelé alely AA-204 na změnu diety obdobně nereagovali (14). Je ovšem třeba přihlédnout i k mezigenovým interakcím, tedy genetickému pozadí, v rámci něhož se sledovaná varianta vyskytuje. Může zde totiž docházet ke značné modulaci výsledného fenotypu. Tento efekt je z výše zmíněných důvodů lépe pozorovatelný u geneticky definovaných modelů (15, 16). Haluzík et al. (16) tento koncept potvrdili studií, kde vnesení mutace ob/ob v genu pro leptin do genomu dvou odlišných kmenů myši C57BL/6J a FVB/N mělo za následek výrazně odlišnou manifestaci inzulínové rezistence za identických dietních podmínek.
V praxi se jistě bude možné často setkat s ještě komplikovanějšími interakcemi, kde do vztahů diety a genetické informace bude vstupovat vliv farmakoterapie běžných onemocnění. Takovou dietně modulovanou farmakogenetickou interakci jsme nedávno popsali v systému několika geneticky definovaných modelů inzulínové rezistence a dyslipidémie. Pozorovali jsme zásadní rozdíl působení antidiabetika rosiglitazonu na metabolické parametry v závislosti na kombinaci obsahu sacharidů a tuků v dietě a genetické dispozice testovaného jedince (15, 16).
Perspektiva: individualizovaná výživa
Z předcházejícího textu je zřejmé, že nutriční genomika je teprve na začátku svého vývoje a teprve rozsáhlé, systematicky pojaté studie určí, jak významné místo bude mít tento obor v běžné klinické praxi nedaleké budoucnosti. Konečný cíl nutriční genomiky by bylo možné shrnout jako dosažení optimálního dietního režimu pro konkrétního jedince tak, aby byly respektovány nejen kvantitativní a kvalitativní potřeby výživy a aktuální zdravotní stav, ale i genetické dispozice, s cílem zabránit vzniku řady "civilizačních" onemocnění, případně přispět k jejich efektivnější terapii.
Seznam použitých zkratek
- CYP7A1
- cholesterol-7alfa-hydroxyláza
- SNP
- single nucleotide polymorphism
Odkazy

Evropská organizace pro nutrigenomiku http://www.nugo.org/
Literatura
- Müller, M., Kersten, S.: Nutrigenomics: goals and strategies. Nat Rev Genet, 2004, 4, s. 315-322.
- Pausová, Z., Paus, T., Šedová, L., Bérubé, J.: Prenatal exposure to nicotine modifies kidney weight and blood pressure in genetically susceptible rats: a case of gene-environment interaction. Kidney Int, 2003, 64, s.829-35.
- Ozane, S.E., Hales, C.N.: Early programming of glucose-insulin metabolism. Trends Endocrinol Metab, 2002, 13, s.368-373.
- Garfinkel, M.D., Ruden, D.M.: Chromatin effects in nutrition, cancer, and obesity. Nutrition, 2004, 20, s.56-62.
- Kaput, J., Rodriguez, R.L.: Nutritional genomics: the next frontier in the postgenomic era. Physiol Genomics, 2004, 16, s. 166-177.
- Pravenec, M., Wallace, C., Aitman, T.J., Kurtz, T.W.: Gene expression profiling in hypertension research: a critical perspective. Hypertension, 2003, 41, s.3-8.Pravenec, M., Wallace, C., Aitman, T.J., Kurtz, T.W.: Gene expression profiling in hypertension research: a critical perspective. Hypertension, 2003, 41, s.3-8.
- Middleton, F.A., Ramos E.J.B., Xu, Y., Diab, H., Zhao, X., Das, U.N., Meguid, M.: Application of genomic technologies: DNA microarrays and metabolic profiling of obesity in the hypothalamus and in subcutaneous fat. Nutrition, 2004, 20, s.14 -25.
- Glazier, A.M., Nadeau, J.H., Aitman, T.J.: Finding genes that underlie complex traits. Science, 2002, 298, 2345-9.
- Newman, D.L., Abney, M., Dytch, H., Parry, R., McPeek, M.S., Ober, C.: Major loci influencing serum triglyceride levels on 2q14 and 9p21 localized by homozygosity-by-descent mapping in a large Hutterite pedigree. Hum. Mol. Genet, 2003. 12, 137-44.
- Pausová, Z., Šedová, L., Bérubé, J., Hamet, P., Tremblay, J., Dumont, M., Gaudet, D., Pravenec, M, Křen, V., Kuneš, J.: A segment of rat chromosome 20 regulates diet-induced augmentations in adiposity, glucose intolerance, and blood pressure. Hypertension, 2003, 41, s.1047-1055..
- Snyder, E.E., Walts, B., Pérusse, L., Chagnon, Y.C., Weisnagel, S.J., Rankinen, T., Bouchard, C.: The human obesity gene map: the 2003 update. Obes. Res., 2004, 12, s. 369-439.
- Šeda, O.: Comparative gene map of triglyceridemia. Folia Biol (Praha), 2004, 50, s. 43-57.
- Daly, M.J., Rioux J.D., Schaffner, S.F., Hudson, T.J., Lander, E.S.: High-resolution haplotype structure in the human genome. Nat Genet., 2001, 29, s. 229-231.
- Enattah, N.S., Sahi, T., Savilahti, E., Terwilliger, J.D., Peltonen, L., Jarvela, I.: Identification of a variant associated with adult-type hypolactasia. Nat Genet, 2002, 30, s. 233-237.
- Hubáček, J.A., Piťha, J., Škodová, Z., Poledne, R., Lánská, V., Waterworth, D.M., Humphries, S.E., Talmud, P.J.; Czech MONICA Study.:Polymorphisms in CYP-7A1, not APOE, influence the change in plasma lipids in response to population dietary change in an 8 year follow-up; results from the Czech MONICA study. Clin Biochem, 2003, 36, s.263-7.
- Bílá, V., Křen, V., Liška, F.: The influence of the genetic background on the interaction of retinoic acid with Lx mutation of the rat. Folia Biol (Praha), 2000, 46, s.264-72.
- Haluzík, M., Colombo, C., Gavrilova, O., Chua, S., Wolf, N., Chen, M., Stannard, B., Dietz, K.R., Le Roith, D., Reitman, M.L.: Genetic Background (C57BL/6J Versus FVB/N) Strongly Influences the Severity of Diabetes and Insulin Resistance in ob/ob Mice. Endocrinology, 2004, 145, s.3258-64.
- Šeda, O., Kazdová, L., Corbeil, G., Tremblay, J., Křenová, D., Křen, V., Hamet, P.: High-fat diet modulates rosiglitazone action in a genetic model of metabolic syndrome. Int J Obes Relat Metab Disord, 2004, 28 (Suppl.1), s.S27.
- Šeda, O., Kazdová, L., Corbeil, G., Tremblay, J., Křenová, D., Křen, V., Hamet, P.: Comprehensive gene expression and metabolic analysis of a complex gene-environment interaction among rosiglitazone, high-fat-high-cholesterol diet and rat chromosome 4. J Hypertens, 2004, 22 (Suppl.2), s.S73.