Aktuální genetika
Multimediální učebnice lékařské biologie, genetiky a genomikyFarmakogenetika a farmakogenomika
Historická perspektiva
Pozorování individuálních odlišností v reakci na podanou látku (lék) provázejí lidstvo odnepaměti. Jedno z prvních "farmako/nutrigenetických" zjištění je připisováno Pythagorovi, který si všiml, že někteří lidé onemocní po požití favových bobů, zatímco jiní nikoli. Trvalo přibližně 2400 let, než byla objasněna podstata tohoto jevu, totiž defekt enzymu glukóza-6-fosfát dehydrogenázy, v jehož důsledku dochází po pozření syrových bobů nebo např. po podání antimalarika primachinu (ale i kyseliny acetylsalicylové, fenacetinu nebo sulfonamidů) k hemolytické anémii (2).
Sir A.E. Garrod v roce 1902 předjímá, že účinky diety a dalších onemocnění mohou "maskovat" některé vrozené poruchy metabolismu a zavádí pojem "chemické individuality", kdy specifické reakce na léky jsou připisovány vrozeným odlišnostem - předbíhá tak o více než 50 let vznik farmakogenetiky a nutrigenetiky.
Přibližně v téže době William Bateson znovuobjevuje Mendelovu práci a de facto zavádí termín genetika. Navíc to byl pravděpodobně právě Bateson, kdo aplikoval genetiku na Garrodem popsané vrozené poruchy metabolismu. Teprve v padesátých letech minulého století dochází k ustavení farmakogenetiky jako takové, když jsou popsány tři, nyní již klasické případy farmakogentických interakcí.
Prvním z nich byla již zmíněná hemolytická anémie po podání primachinu u disponovaných osob, dále protrahovaná apnoe po podání sukcinylcholinu v důsledku změněné kinetiky butyrylcholinesterázy (3) a nakonec asi nejznámější polymorfismus - rychlá a pomalá acetylace antituberkulotika isoniazidu (teprve v devadesátých letech byly objasněny kauzální mutace genu N-acetyltransferázy 2) (4, 5). Samotný termín farmakogenetika poprvé použil Friedrich Vogel v roce 1959 (6). V druhé polovině 20. století dochází jak v farmakologii, tak genetice k bouřlivému vývoji. Do každodenní lékařské praxe bylo v tomto období zavedeno obrovské množství syntetických léčiv. S tím, jak se kontinuálně zvyšuje účinnost léků, souběžně narůstá i význam jedinečné odpovědi na podání farmak na škále od žádoucího terapeutického efektu až po život ohrožující stavy coby projevu nežádoucího účinku. V roce 1997 se poprvé objevuje termín farmakogenomika (7) a přibližně od té doby je možné sledovat exponenciální nárůst publikací s farmakogenetickou a farmakogenomickou tematikou. Tyto dva pojmy se sice někdy zaměňují, ale rozhodně nejsou totožné. Zjednodušeně lze říci, že farmakogenetika se zabývá vlivem jednotlivých genetických variant na účinek podané látky - léku (viz tři případy farmakogenetických interakcí výše), zatímco farmakogenomika zkoumá vztah účinku léku na úrovni celého genomu, resp. transkriptomu.
Metody farmakogenomiky
Farmakogenomické metody se opírají o současný technologický vývoj, který přinesl možnost vysoce paralelní analýzy genetické informace člověka i modelových organismů. K tomu přistupují bioinformatické metody s matematickým a statistickým aparátem, který umožňuje náhled a zhodnocení výstupních mnohorozměrných biologických dat a někdy je sám hlavním nástrojem zkoumání, např. při tzv. in silico analýzách (rozuměj počítačových) genomických dat ve veřejně přístupných databázích.
Na úrovni genomu se po dokončené sekvenaci stalo jedním ze slibných směrů globální mapování tzv. SNP (single nucleotide polymorphisms), tedy jednonukleotidových variací sekvence DNA. Tyto snahy vycházejí z faktu, že z celkového odhadovaného počtu 11-15 milionů genetických polymorfismů u člověka tvoří přes 90% právě SNP. Ve veřejně přístupné databázi dbSNP (www.ncbi.nlm.nih.gov/SNP/index.html) je v současnosti (build 125 ze 29.9.2005) již přes 5 milionů identifikovaných SNP a jejich počet každým dnem stoupá. SNP se dále sdružují do bloků - haplotypů, které se zpravidla dědí společně. Jeden ze současných názorů na variabilitu lidského genomu říká, že chromozomy jsou složeny především z krátkých segmentů, které v rámci krátké evoluční historie člověka prodělaly minimální počet rekombinačních změn a proto tyto segmenty je možné u většiny populace charakterizovat jen několika častými haplotypy. Pro takové oblasti s vysokou vazebnou nerovnováhou a nízkou diverzitou haplotypů (haplotypové bloky) stačí zase identifikovat jen několik "značek" (např. právě SNP), které zastupují daný haplotyp. Dá se předpokládat, že po dokončení projektů haplotypového mapování lidského genomu (projekt HapMap www.hapmap.org/ ) ve zdrojích jako je pro farmakogenetiku již dnes PharmGKB (pharmacogenetics and pharmacogenomics knowledge base, www.pharmgkb.org ) bude možné zjistit rizikové haplotypy pro konkrétní lék či lékovou skupinu. Pravděpodobně tedy nebude zdaleka nutné znát celou "konstelaci SNP" u daného jedince, aby bylo možné v budoucnu využít genomické informace pacienta pro predikci a případnou prevenci nežádoucích farmakogenetických a nutrigenetických interakcí (8). Již dnes je pomocí tzv. SNP čipů možné hodnotit u zkoumaného vzorku několik set tisíc polymorfismů zároveň. Např. firma Affymetrix distribuuje čipy umožňující detekci 100000 SNP při použití několika set nanogramů DNA a pravděpodobně ještě letos uvede na trh čip pro detekci 500000 SNP (www.affymetrix.com).
Amplichip
Na konci minulého roku oznámila společnost Affymetrix, že americký Úřad pro kontrolu léčiv FDA povolil používání systému "Affymetrix GeneChip® System 3000Dx" pro diagnostické in vitro účely. Je to vůbec poprvé, kdy byl takový atest udělen přístroji pro analýzu DNA/RNA čipů (angl. microarray). Již v září minulého roku získal společný produkt Affymetrix a Roche na bázi zmíněného systému - AmpliChip CYP450 Test - certifikaci CE ("Conformité Européene"), která umožňuje jeho použití v klinické diagnostice v rámci zemí Evropské unie.
První systém Amplichip ve střední Evropě byl instalován letos (15.6.2005) na Ústavu klinické chemie a laboratorní diagnostiky 1.LF UK a VFN.
DNA (příp. RNA) čipy jsou nástroje umožňující současné testování až desítek tisíc genů v jediném vzorku. Na ploše samotného čipu o velikosti cca 1,5 x 1,5 cm jsou velmi hustě umístěny krátké úseky jednořetězcové DNA o známé sekvenci nukleotidů (oligonukleotidové próby). Na základě komplementarity bazí se na ně specificky váže fluorescenčně značená DNA z analyzovaného vzorku (získaná např. z odběru periferní krve). Po laserové detekci prób, na které hybridizovala DNA vzorku, automaticky vyhodnotí nasnímaný obraz analytický software a je generována databáze výsledků, které je možno dále zpracovávat.

Uvedený AmpliChip CYP450 Test je zaměřen na dva geny, které jsou zásadní pro metabolismus až 25% všech podávaných léčiv, a to gen kódující cytochrom P450 (CYP) 2D6 a gen CYP2C19. Patnáct tisíc prób umístěných na čipu umožňuje rozlišit 29 různých polymorfismů, duplikací a delecí genu CYP2D6, dva polymorfismy genu CYP2C19 a na základě této informace přímo predikovat typ metabolismu léčiv - od pomalého po "ultra-rychlý". Z oblasti výzkumu tak do klinické medicíny přichází jeden z prvních farmakogenetických nástrojů, který by měl nejen přispět k prevenci případných nežádoucích účinků farmakoterapie u geneticky disponovaných jedinců, ale především má ambice se stát technologickým milníkem na cestě k individualizaci terapie s přihlédnutím ke genetické výbavě pacienta. Limitujícím faktorem pro masivnější rozšíření tohoto diagnostického nástroje je prozatím jeho poměrně vysoká cena (350-400 USD za čip, tedy 1 vyšetření) a především pořizovací cena vlastního systému firmy Affymetrix (cca 100.000 USD).
Roche Amplichip
http://www.roche-diagnostics.com/products_services/amplichip_cyp450.html
Affymetrix
www.affymetrix.com
Jednou ze zásadních informací, kterou přinesla možnost paralelního stanovení exprese tisíců (na úrovni mikroorganismů někdy i všech) genů, bylo potvrzení dynamické povahy genomu. Mezi posloupností nukleotidů DNA a expresí genu totiž neexistuje žádný mechanistický vztah, zasahuje sem řada regulačních pochodů a úprav na všech mezistupních realizace genetické informace (postranskripční, postranslační úpravy, na RNA závislá regulace exprese atd.). Detailní popis těchto mechanismů přesahuje rámec tohoto přehledu, ale ve zkratce lze říci, že na již úrovni buňky dochází k analýze a integraci signálů přicházejících z vnitřního i vnějšího prostředí a teprve na základě této informace je "volena" časoprostorově specifická forma odpovědi zahrnující mj. i nastavení exprese vybrané sady genů. Po vyřazení funkce jediného genu u knock-out myší nebo přidání jediného signálu v podobě farmaka do media buněčné kultury lze identifikovat adaptivní posun v expresi ne jednotlivých, ale stovek až tisíců genů. Na úrovni transkriptomu jsou tak užívány cRNA a cDNA expresní čipy (microarrays) dosahující značné denzity prób - pro člověka, myš i potkana již jsou běžně k dispozici čipy, kterými je možné detekovat naráz expresi všech dosud anotovaných genů i dosud neidentifikovaných exprimovaných sekvencí (viz kapitola Geny na čipech). Analogicky expresi na úrovni proteinů a metabolitů zkoumá proteomika (viz kapitola Úvod do proteomiky), resp. metabolomika, opět s využitím moderních technologií založených na variantách hmotnostní spektrometrie. Zde je třeba zmínit určité panující rozpaky ohledně praktického rutinního využití zmíněných technik. Biologický materiál pro tyto analýzy se reálně může rekrutovat z odběrů krve nebo exkretů (moč, sliny, mateřské mléko atd.), případně z biopsií tkání, kde jsou relevantní geny exprimovány. Pokud tedy nebudou nalezeny "signatury exprese" specifické např. pro nežádoucí reakci na lék v běžně dostupném biologickém materiálu, zůstane na rozdíl od genotypizace význam těchto metod především v oblasti experimentu.
Farmakogenetické interakce
Většina původních farmakogenetických pozorování se týkala znaků, u kterých bylo možné sledovat radikální rozdíly např. v koncentraci léčiva v krvi nebo odpad jejích metabolitů močí a které podléhaly jednoduché mendelovské dědičnosti. Takové polymorfismy jsou podmíněny změnami ve farmakokinetice, kdy kvůli defektu v molekule příslušného transportéru, metabolizujícího enzymu nebo některého z ostatních faktorů podílejících se na absorpci, distribuci, interakci s cílovou strukturou a nakonec odbourání a exkreci dochází k přílišné nebo nedostatečné koncentraci farmaka v organismu. Klasickými případy jsou již zmíněný polymorfismus v genu pro N-acetyltransferázu 2 (NAT2), dále polymorfismy v genech pro cytochrom P450 2D6 (CYP2D6) (9) nebo thiopurin S-methyltransferázu (TPMT) (10). Tento enzym podílející se na metabolismu thiopurinů, např. azathioprinu (užívaného mj. pro imunosupresi u příjemců transplantátů a při léčbě akutní lymfoblastické leukémie), se stal také jedním z prvních, u kterých je k dispozici komerčně vyráběný genetický test (www.prometheuslabs.com/). Varování před vážnými nežádoucími účinky v případě podání azatioprinu pacientům s genotypem determinujícím nízkou aktivitu TPMT bylo schválenou americkou FDA a je obsaženo přímo v příbalovém letáku.
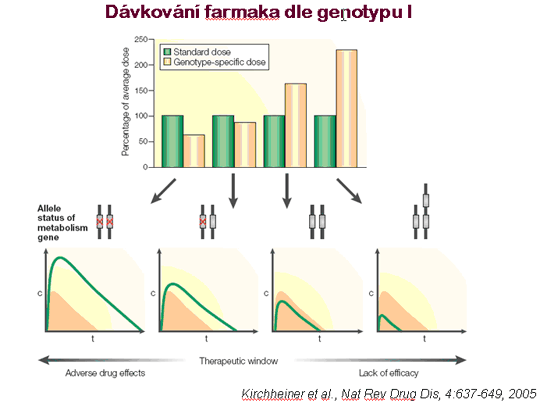
Komplikovanější situace nastává, zasahuje-li genetický polymorfismus do farmakodynamických procesů nebo je závislý na interakci několika genů. Potom i při adekvátní koncentraci léčiva závisí jeho účinek na faktorech jako je stupeň exprese cílového genu v dané tkáni. Exprese genu může být systematicky nižší nebo vyšší u různých etnických skupin (pro což svědčí například zavedení léku BiDil specificky pro srdeční selhání u Afro-američanů) nebo záviset na fázi vývoje organismu (novorozenci, děti, adolescenti, dospělí). Je možné, že právě takové polymorfismy stojí za pozorováním, že antidepresivum paroxetin ze skupiny selektivních inhibitorů zpětného vychytávání serotoninu (SSRI) vyvolává u pacientů mladších 18 let sebepoškozující až suicidální jednání na rozdíl od pacientů dospělých, kde k těmto reakcím nedochází (11).
Komplikující faktor - heterogenita
V rámci výzkumu farmakogenetických interakcí se setkáváme s obdobnými problémy jako při zkoumání genetické složky komplexních nemocí, tedy takových znaků, kde kromě genetiky hrají významnou roli i faktory prostředí, mezi něž mj. potravu a farmaka řadíme. Mezi tyto překážky patří mj. neúplná penetrance (ne u všech, u kterých to na základě jejich genetické dispozice očekáváme, se daný fenotyp projeví), genetická heterogeneita v rámci populačního vzorku, u kterého je studie prováděna, fenokopie (projev daného fenotypu u jedinců, kteří nezdědili příslušnou sadu patologických alel) a další (14). Jak uvádí Thornton-Wells et al. (15), genetická heterogenita může být dvojího typu. První z nich je heterogenita alelická, tedy asociace mezi daným znakem (onemocněním, reakcí na lék) a dvěma či více alelami stejného lokusu - příkladem budiž cystická fibróza s více než 1000 popsanými mutacemi genu CFTR nebo mnohotné alely cytochromu P450. Druhou formou je potom heterogenita samotného znaku, kdy nedostatečně specifická definice zahrnuje několik geneticky oddělených entit, jako je tomu u autismu a pravděpodobně i u hypertenze. Tyto faktory musí být samozřejmě reflektovány v použití nových statistických modelů a postupů, neboť většina dosud používaných metod je založena na matematickém aparátu, který kalkuluje s jednoduchým monogenním typem dědičnosti. Jsou proto vyvíjeny různé varianty shlukovacích, faktorových či Bayesiánských analýz.
Příklady experimentálních farmakogenetických modelů
Pro detailní funkčně genomickou analýzu genetických polymorfismů v rámci komplikovaných vazeb farmakogenetických interakcí je z důvodů etických a mnohdy i praktických nemožné studovat relevantní biologické a fyziologické pochody přímo u lidských subjektů. Různé fáze výzkumu proto musí probíhat za použití modelů in silico (počítačové modely), in vitro (buněčné kultury) a in vivo (experimentální, především savčí modely), které jsou teprve následně validovány u člověka. Nejjednoduššími fyzickými modely jsou buňky exprimující polymorfní varianty lidských genů vnesených transfekcí cDNA. Cílem těchto studií je zjistit, jak jednotlivé polymorfismy ovlivňují expresi a funkci jimi kódovaného proteinu (např. receptoru). Přes nesporné úspěchy tohoto přístupu je relevance výstupů pro konkrétní klinicko-patologický stav problematizována několika faktory. Především, nejčastějším modelem jsou buněčné linie, u kterých je sice snadné docílit transfekcí exprese žádaného genu a následně proteinu, ale mnohé jejich charakteristiky neodpovídají buňkám původního typu tkáně. Navíc buněčné studie "vytrhují" danou buňku z přirozených vazeb prostředí (tkáně, orgánu i celého organismu) tvořených sítěmi adaptivních a regulačních signálů, které navíc nabývají specifických forem v kontextu patofyziologie příslušného onemocnění a reakce na medikaci. Proto je poměrně značná důležitost kladena na výzkum za použití experimentálních zvířecích modelů, v současnosti nejčastěji myši a laboratorního potkana. Tradiční roli těchto dvou modelů dále podpořily výsledky sekvenace jejich genomů, která ukázaly, že evolučně je člověk podstatně blíže těmto dvěma savcům, než se obecně očekávalo (16). V podmínkách živého organismu je možné za standardních podmínek prostředí cíleně modifikovat genom a zpětně sledovat efekt takové změny, mezi metody již rutinně užívané patří dnes transgeneze, tedy cílená exprese vnesené varianty genu (např. lidského), případně "knock-out" a v poslední době i "knock-down" postupy, které buď úplně, nebo částečně vyřadí specifický gen z funkce.
Konkrétním příkladem savčího modelu vhodného pro farmakogenomický a nutrigenomický výzkum je kmen polydaktylního potkana (PD/Cub). Tento vysoce inbrední kmen je na Ústavu biologie a lékařské genetiky 1.LF UK a VFN chován od roku 1969 (17). Spontánně vzniklá mutace genu Lx dává vznik syndromu polydaktylie-luxace. Účinek genu Lx je modifikován jednak účinkem genetického pozadí, jednak interakcí s různými teratogenními látkami (bromodeoxyuridin, thalidomid, retinová kyselina), a to opět v závislosti na genetickém pozadí (18-21). Tento kmen je tedy jedinečným modelem pro analýzy morfogenetických procesů i farmakogenetiky/genomiky teratogeneze. V roce 1993 byla u PD/Cub zjištěna zvýšená hladina triglyceridů (22) a detailnější zkoumání pak vedlo k ustavení kmene PD/Cub jako modelu metabolického syndromu, neboť kromě hypertriglyceridémie byla u tohoto kmene identifikována hyperinzulinémie, zvýšená hmotnost epididymálního tukového tělesa (marker obesity centrálního typu), zvýšená hladina nenasycených mastných kyselin a výrazná inzulínová rezistence (23). Teprve nedávno se ukázalo, že PD/Cub má i jedinečný farmakogenetický i farmakogenomický profil v rámci podávání látek modulujících genovou transkripci (24, 25). Po podání hypolipidemika fenofibrátu, agonisty nukleárního receptoru PPAR? překvapivě došlo k zhoršení glukózové tolerance spojené s hyperinzulinémií. Isotretinoin, panagonista receptorů RAR a RXR vyvolal u kmene PD/Cub výrazný vzestup triglyceridémie, což je jeden z popisovaných nežádoucích účinků léčby např. dermatologických afekcí touto látkou. Jelikož se ovšem tato reakce vyskytuje pouze u určité části léčených, je možné, že se jedná o geneticky podloženou interakci a polydaktylní potkan by tak mohl být vhodným nástrojem pro její detailnější zkoumání (24).

Obrázek 3: Samec polydaktylního kmene potkana (PD/Cub).
V poslední době se v léčbě inzulínové rezistence poměrně často užívají agonisté dalšího z nukleárních receptorů, PPAR? (např. thiazolidinediony pioglitazon, rosiglitazon) (26). U jiného modelu inzulínové rezistence a dyslipidémie, spontánně hypertenzního potkana (SHR/OlaIpcv), překvapivě nevedlo podávání pioglitazonu k zlepšení tolerance glukózy (27). Ukázalo se, že hlavní příčinou této reakce je mutovaná alela genu pro translokázu mastných kyselin Cd36/Fat, což bylo potvrzeno pomocí derivace transgenních a kongenních zvířat, která exprimují normální variantu Cd36/Fat a na pioglitazon reagují oproti SHR/OlaIpcv zlepšením metabolických parametrů a utilizací glukózy v periferních tkáních. Konkrétní realizace této farmakogenetické interakce opět závisí i na alelické kombinaci genetického pozadí. U kongenního kmene BN.SHR(Il6-Cd36) je Cd36/Fat SHR původu vneseno na genetické pozadí normolipidemického a normotenzního kmene Brown Norway. Po podání rosiglitazonu jsme kromě zmíněné absence zlepšení glukózové intolerance pozorovali i chybění nárůstu adiposity, ke kterému došlo jak u kontrolního kmene BN/Cub, tak u SHR/OlaIpcv po podání pioglitazonu (28). Vzhledem k relativně častému výskytu diabetu 2. typu u lidských nositelů mutované varianty CD36 může mít tato experimentálně zjištěná farmakogenetická interakce význam pro farmakoterapii diabetu u těchto pacientů.
Využití farmakogenomiky ve vývoji nových léčiv
Kromě toho, že je nyní možné aplikovat metody farmakogenetiky a farmakogenomiky pro porozumění interakcím a optimalizaci terapie již zavedených léčiv, pozornost nejen farmaceutických výrobců se upírá na oblasti, kde by bylo možné nové technologie využít při vývoji a kontrole nových preparátů Nasnadě je např. využití dostupných sekvencí DNA člověka a modelových organismů pro poměrně rychlý počítačový screening charakteristických motivů společných genům, pro které jsou již vytvořeny rozsáhlé testovací knihovny chemických látek ("drug-able targets"). Mezi takové skupiny patří např. nukleární receptory nebo kinázy. Jak uvádí A. Roses, než byl tento postup možný, bylo k dispozici cca 500 takových cílových struktur a zdá se, že existuje asi ještě 5000 dalších, z nichž stovky mohou být relevantní z hlediska léčby lidských onemocnění (29). Jediná fáze tohoto výzkumu, která není a asi nebude přístupná auomatizaci a robotizaci, je získání DNA společně s co nejširší nejpřesnější charakterizací samotných pacientů (nemocných i kontrol) a chybění široce založených detailně anotovaných prospektivních kohort. Dalším polem, kde by farmakogenomické metody mohly v budoucnu sehrát zásadnější úlohu, jsou primární fáze klinického testování léčiv. U těch preparátů, které vykazují účinnost jen u určité skupiny léčených a v celkovém srovnání s placebem je výsledek ambivalentní, vyžaduje pokračování studií značné investice a mnohdy je celý vývoj právě zde ukončen. Profilování by mohlo identifikovat genetické charakteristiky skupiny, u které se dostavuje požadovaný efekt léčiva a v případě potvrzení účinnosti v dalších fázích klinického testování by mohla být pozitivita v předběžném (prediktivním) genetickém testu podmínkou aplikace daného léčiva. Z různých důvodů zatím ovšem nedošlo k distribuci léku s tak jednoznačnou specifikací genetických markerů pacienta, které by zajišťovaly jak účinnost, tak bezpečnost jeho podávání. Opačným případem je identifikace genetického markeru (SNP, haplotypu, alely, transkripčního profilu), který je asociován s nežádoucím účinkem léčiva. Příkladem budiž hyperbilirubinémie, ke které došlo u 4% z 11500 pacientů léčených tranilastem (preparát proti restenóze) v rámci fáze III klinického testování. Rozsáhlým genetickým testováním se zjistilo, že tato reakce je jednoznačně spojena s alelou genu pro UDP-glukuronosyl transferázu 1A1 (30). U těch jedinců, kteří měli jednu alelu obsahující 7 repetic, vyvolal tranilast mírnou hyperbilirubinémii, při výskytu obou alel se 7 repeticemi došlo k významné hyperbilirubinémii, zatímco dvě alely s šesti repeticemi "chránily" jejich nositele před tímto nežádoucím účinkem tranilastu, jehož vývoj byl nakonec zastaven. Dalším zkoumáním bylo zjištěno, že k jednoznačné identifikaci této genomické oblasti by při použití dostupné sady pro genotypzaci 100000 SNP stačilo jen 10-20 případů vykazujících hyperbilirubinémii ve srovnání s 3000 kontrol. Samozřejmě u nežádoucích účinků, jejichž patogeneze je komplexnější (více genů, vliv dalších faktorů), je situace podstatně složitější. Proces přechodu od globálně aplikovaných léků "na danou nemoc" k lékům "pro konkrétního pacienta" v rámci individualizované medicíny (angl. personalized medicine) bude tedy patrně jen velmi pozvolný.
Literatura
- Hood L, Heath JR, Phelps ME, Lin B. Systems biology and new technologies enable predictive and preventative medicine . Science 2004;306:640-643.
- Carson PE, Flanagan CL, Ickes CE, Alving AS. Enzymatic deficiency in primaquine-sensitive erythoytes. Science 1956;124:484-485.
- Lehmann H, Ryan E. The familial incidence of low pseudocholinesterase level. Lancet 1956;271:124.
- Bőnicke R, Reif W. Enzymatische Inaktivierung von Isonicotinsäure hydrazide im menschlichen und tierischen Organismus. Arch. Exp. Pathol. Pharmakol. 1953;220:321-333.
- Blum M, Demierre A, Grant DM, Heim M, Meyer UA. Molecular mechanism of slow acetylation in man. Proc. Natl. Acad. Sci. USA 1991;88:5237-5241.
- Vogel F. Moderne Probleme der Humangenetik. Ergebn. Inn. Med. Kinderheilkd. 1959;12:52-125.
- Marshall A. Genset-Abbott deal heralds pharmacogenomics era. Nat Biotechnol. 1997;15:829-30.
- Deloukas P, Bentley D. The HapMap project and its application to genetic studies of drug response. Pharmacogenom J 2004;4:88-90.
- Ingelman-Sundberg M. Pharmacogenetics of cytochrome P450 and its applications in drug therapy: the past, present and future.
- Weinshilboum RM, Sladek SL. Mercaptopurine pharmacogenetics: monogenic inheritance of erythrocyte thiopurine methyltransferase activity. Am J Hum Genet 1980;32:651-652.
- Marx V. Pharmacogenomics shapes pediatrics' future. Genomis and Proteomics 2004;4:12-18.
- Nebert WN, Vesell, ES. Advances in pharmacogenomics and individualized drug therapy: exciting challenges that lie ahead. Eur J Pharmacol 2004;500:267-280
- Chang JT, Altman RB. Extracting and characterizing gene-drug relationships from the literature. Pharmacogenetics. 2004;14:577-86.
- Hatina J, Sykes B. Lékařská genetika. Academia Praha 1999: 226-268.
- Thornton-Wells TA, Moore JH, Haines JL. Genetics, statistics and human disease: analytical retooling for complexity. Trends Genet 2004;20:640-647.
- Rat Genome Sequencing Project Consortium. Genome sequence of the Brown Norway rat yields insights into mammalian evolution Nature 2004;428:493 - 521.
- Křen V. Genetics of the polydactyly-luxate syndrome in the Norway rat, Rattus norvegicus. Acta Univ Carrol Med Praha (Monogr.) 1975;68:1-103.
- Bílá, V., Křen, V. (1988) Use of the polydactyly-luxation syndrome in rats for studying the interaction of the genome with teratogenic factors Sb Lek. 90(2-3), 90-96.
- Bílá, V., Křen, V. (1994) Evidence for teratogenicity of thalidomide using congenic and recombinant inbred rat strains. Folia Biol. (Praha) 40(4), 161-71.
- Bílá, V., Křen, V. (1996) The teratogenic action of retinoic acid in rat congenic and recombinant inbred strains. Folia Biol. (Praha) 42, 167-173.
- Bílá, V., Křen, V., Liška, F. (2000) The influence of retinoic acid teratogenicity on the interaction of retinoic acid with Lx mutation of the rat. Folia Biol. (Praha) 46, 260-268
- Vrána A, Kazdová L, Dobešová Z et al. Triglyceridemia, glucoregulation, and blood pressure in various rat strains Effects of dietary carbohydrates. Ann NY Acad Sci 1993;683:57-68.
- Šedová L Kazdová L, Šeda O, Křenová D, Křen V. Rat inbred PD/Cub strain as a model of dyslipidemia and insulin resistance. Folia Biol (Praha) 2000;46:99-106.
- Šedová L, Šeda O, Křenová D, Křen V, Kazdová L. Isotretinoin and fenofibrate induce adiposity with distinct effect on metabolic profile in a rat model of the insulin resistance syndrome. Int J Obes Relat Metab Disord 2004;28:719-725.
- Šeda O, Kazdová L, Křenová D, Křen V. Rosiglitazone improves insulin resistance, lipid profile and promotes adiposity in genetic model of metabolic syndrome X. Folia Biol (Praha) 2002;48:237-241.
- Šeda O, Šedová L. PPARs: molecular targets in the pharmacogenomics era. Prague Medical Report 2004;205:223-236.
- Qi N, Kazdová L, Zídek V et al. Pharmacogenetic evidence that cd36 is a key determinant of the metabolic effects of pioglitazone. J Biol Chem 2002;277:48501-48507.
- Šeda O, Kazdová L, Křenová D, Křen V. Rosiglitazone fails to improve hypertriglyceridemia and glucose tolerance in CD36-deficient BN.SHR4 congenic rat strain. Physiol Genomics 2003;12:73-78.
- Roses AD. Pharmacogenetics and drug development: the path to safer and more effective drugs. Nat Rev Genet 2004;5:645-656
- Danoff TM, Campbell DA, McCarthy et al. Pharmacogenomics J 2004;4:49-53.
- Šedová L, Šeda O. Nutriční genomika. Čas. Lék. čes. 2004;143:676-678.
- Kaput J, Rodriguez RL. Nutritional genomics: the next frontier in the postgenomic era. Physiol Genomics 2004;16:166-177.
- Müller M, Kersten S. Nutrigenomics: goals and strategies. Nat Rev Genet 2004;4: 315-322.
Zdroje a další čtení
- Šeda O., Šedová L. (2005): Farmakogenomika a nutrigenomika: komplexní interakce genů s prostředím. Klin Farmakol Farm 19, 46-50.
- Šedová L., Šeda O. (2004): Nutriční genomika. Čas. Lék. čes. 143, 676-678.
- The Pharmacogenetics And Pharmacogenomics Knowledge Base - www.pharmgkb.org
- The Pharmacogenomics Journal - www.nature.com/tpj/index.html
- Pharmacogenetics and Genomics -
www.jpharmacogenetics.com/pt/re/pharmgen/home.htm