Aktuální genetika
Multimediální učebnice lékařské biologie, genetiky a genomikyPohlaví a genetika
Určení pohlaví
U člověka je pohlaví určeno přísně geneticky. Tato skutečnost se stala průkaznou díky studiu Turnerova a Klinefelterova syndromu. Jedinci s Turnerovým syndromem, cytogenetickou abnormalitou s karyotypem 45, X, se vyvíjí jako ženy. Mají všechny deriváty Müllerova vývodu, tj. dělohu a vejcovody, nemají deriváty Wolfova vývodu, mají ovaria a i psychosociálně se vyvíjí jako ženy. Nicméně u nich pozorujeme mnoho patologických znaků. Mnoho z pozorované patologie může vznikat ze selhání redukčního dělení (meiózy) u vajíček (v průběhu fetálního vývoje), pravděpodobně díky přítomnosti nepárového chromozomu X. Oocyty postupně hynou a v pubertě již ovaria neobsahují žádné folikuly. Ovaria tudíž neprodukují žádné hormony - nevzniká endometriální (menstruační) cyklus, pubertální vývoj je narušen, dochází k předčasné ateroskleróze a osteoporóze. To znamená, že chybění chromozomu Y vede k vývoji ženského pohlaví, porucha pohlavního vývoje v pubertě je sekundární, v důsledku deplece oocytů.
Jedinci s Klinefelterovým syndromem mají karyotyp 47, XXY. Přestože mají dva chromozomy X, z nichž se jeden inaktivuje (stejně jako u žen s normálním karyotypem 46, XX), jsou jedinci s tímto karyotypem mužského pohlaví, i když mají potíže s plodností a deficitem androgenů.
Z klinického obrazu těchto dvou syndromů můžeme uzavřít, že Y chromozom determinuje samčí pohlaví - kdykoli je chromozom Y přítomen, je zahájen samčí vývojový program. Pokud chromozom Y chybí, zahájí se procesy vedoucí k vytvoření samičího pohlaví. Počet ("dávka") X chromozomů neovlivňuje určení pohlaví.
Analýzou myšího a lidského "zvratu pohlaví" (samci XX a samice XY) bylo zjištěno, že za zahájení vývoje samčího pohlaví je zodpovědný gen Sry (Sex determining region on chromosome Y, oblast určující pohlaví na chromozomu Y). ¨Gen Sry leží v oblasti krátkého raménka chromozomu Y, která je specifická pro muže, směrem 3´ od pseudoautosomální oblasti 1 (pseudoautosomal region 1, PAR1). Vzácně se může objevit crossing-over nikoli v PAR1, kde je obligátní, ale v přilehlé sekvenci, která jeví určitou podobnost s chromozomem X. V tomto případě je gen Sry translokován na X chromozom, výsledkem je samec (muž) 46, XX.
Protein Sry je transkripční faktor z rodiny HMG (high mobility group). Sry je exprimován v podpůrných buňkách nediferencované gonády a způsobuje jejich diferenciaci v Sertoliho buňky. Ty se organizují do epiteliálních "čepů", obalují germinální buňky a indukují jejich diferenciaci v prospermatogonie. Tyto epiteliální čepy se později luminizují a stávají se z nich semenotvorné kanálky.
Gen Sry není exprimován jen ve varlatech, ale i v mozku, konkrétně byl nalezen v substantia nigra, kde zvyšuje expresi tyrosin hydroxylázy, enzymu potřebného pro tvorbu dopaminu. Pokud se u myší exprese Sry v substantia nigra "vypne", dojde u zvířat k rozviji příznaků Parkinsonovy choroby. Závislost syntézy dopaminu na Sry u mužů by mohlo vysvětlit jejich větší náklonnost ke vzniku Parkinsonovy choroby (relativní riziko 1,5). U žen je substantia nigra patrně menší (potvrzeno u myší - rozdíl 20%), ale syntéza dopaminu je řízena jinak a je patrně stabilnější.
Cílovým genem, jehož exprese je aktivována proteinem Sry, je Sox9 (Sex determining region Y [Sry]-related box-9), transkripční faktor patřící také do rodiny HMG. Sox9 leží na chromozomu 17q24. Mutace tohoto genu způsobují kampomelickou dysplazii - syndrom, u kterého je karyotyp 46, XYspojen s ženským pohlavím a s dysplázií skeletu (Sox9 je také nezbytný pro vývoj chrupavky). Duplikace genu Sox9 způsobuje u jedinců s karyotypem 46, XX zvrat v mužské pohlaví. Všechno do sebe zapadá - snížení funkce Sox9 vede k vývoji ženského pohlaví, zvýšení exprese Sox9 podpoří vývoj pohlaví mužského.
Jedna z metabolických drah aktivovaných proteinem Sry je akumulace glykogenu v pre-Sertoliho buňkách díky stimulaci vstupu glukózy do buněk přes signální dráhu insulin/IGF (insulinu podobný růstový faktor). Uskladnění energie ve formě glykogenu je nezbytné pro masivní proliferaci Sertoliho buněk a tím pro vývoj varlete. U myší s komplementem pohlavních chromozomů XY s mutací ve všech genech pro insulínové receptory (Ir, Igf1r and Irr) se vyvíjí ovaria a úplný samičí fenotyp.
Krátce po indukci produktem genu Sry začínají Sertoliho buňky plnit řadu úkolů: Zaprvé indukují diferenciaci primordiálních zárodečných buněk ve spermatogonie - v procesu spojeném s utvářením "semenných provazců" ze Sertoliho buněk, které obklopí a uzavřou prekurzory spermatogonií. Jaké povahy je diferenciační signál pro zárodečné buňky (a jaká je role samotných zárodečných buněk) není dostatečně jasné, jedním z kandidátů je prostaglandin D2. Zadruhé Sertoliho buňky produkují AMH (anti-müllerický hormon), který způsobuje dezintegraci Müllerova vývodu a blokuje tak vývoj derivátů Müllerova vývodu, dělohy a vejcovodů. Zatřetí Sertoliho buňky zodpovídají za diferenciaci Leydigových buněk. Leydigovy buňky pak produkují androgeny, které částečně řídí sestup varlete a které jsou plně odpovědné za maskulinizaci zevního genitálu. Po této fetální periodě produkce androgenů, zejména testosteronu, klesá. Hladina testosteronu se opět zvyšuje v pubertě, jejíž průběh je silně závislý na androgenech.
Mutace v genu pro androgenní receptor (AR, lokalizován na X chromozomu) způsobují "syndrom necitlivosti k androgenům" (AIS, androgen insesitivity syndrome). Pokud je funkce receptoru úplně nulová, tedy kompletní AIS (CAIS), nazývaný také "testikulární feminizace". Jedincům XY se vyvine ženský zevní genitál, puberta a psychosociální vývoj je také ženský. Nicméně se jedná o posttestikulární blokádu, neboť tyto ženy mají varlata, která produkují testosteron a částečně sestupují (mohou být často nalezena např. v inguinálním kanálu nebo v stydkých pyscích). Protože varlata produkují i AMH, tyto ženy nemají dělohu a vejcovody a tak mohou být zachyceny pod diagnózou "primární amenorhea". Zvláštní znak je chybějící pubické a axilární ochlupení, jehož vývoj je také závislý na androgenech.
Diferenciace samičího pohlaví je v primordiální gonádě iniciována pokud není exprimován gen Sry, jako implicitní vývojová dráha. Zárodečné buňky se diferencují v prekurzory oocytů, proliferují, rekrutují folikulární buňky a prodělávají první redukční dělení, které se však zastaví v diplotenním stadiu až do ovulace. Toto velmi dlouhé diplotenní stadium se nazývá diktyotén. Nicméně existují nové důkazy, že se oocyty mohou vyvíjet ze zárodečných kmenových buněk, diferencovaných de novo z célomového epitelu ovarií. Bez tohoto stále kontroverzního mechanismu regenerace oocytů procházejí všechny oocyty meiotickou profází ve fetálních ováriích. Pokud, např. po 45 letech, je jeden folikul vybrán a roste, oocyt dokončí první meitické dělení těsně před ovulací. Po ovulaci druhé zrací dělení pokračuje až po metafázi (metafáze II). Zde se dělení opět zastaví a pokračuje až po oplození.
Sestup varlat
Kryptordidismus je nejčastější porucha vývoje pohlavních orgánů (3% novorozenců, část se však spontánně upraví, v 1 roce je to už jen 1%). Komplikace porušeného sestupu varlat zahrnují nejen neplodnost, ale i zvýšené riziko maligních nádorů varlete.
U myši byly popsány mutace v genech Insl3, Great a Hoxa10 způsobující infertilitu díky kryptorchidismu. Pohlavně dimorfní poloha gonády je dána dimorfním vývojem dvou částí genitálního mezenteria, lig. suspensorium craniale (CSL) a gubernaculum testis. U mužů je transabdominální fáze sestupu varlat charakterizována přesunem varlete do inquinální oblasti díky zesilování gubernákula a regresi CSL. U žen je tomu přesně naopak, vyvíjející se CSL drží ovarium v blízkosti ledvin. V druhé, inguinoskrotální fázi, je sestup varlete do skrota řízen regresí gubernákula. Regrese CSL je pravděpodobně řízena androgeny z Leydigových buněk. Zbytnění gubernákula (a diferenciace hladkosvalových elementů napovídající, že mechanismem sestupu by mohla být aktivní kontrakce) je stimulováno Insl3 (insulin-like hormone 3, inzulínu podobný hormon 3) dalším z hormonů produkovaných Leydigovými buňkami. Podstata hypotetického receptoru pro Insl3 v gubernákulu není jasná. Je tedy zajímavé, že receptor s neznámým ligandem, Great (G-protein coupled receptor affecting testis descent, receptor spřažený s G-proteinem ovlivňující sestup varlat) je exprimován v gubernákulu a jeho mutace vedou ke kryporchidismu u myší i u lidí. Dalším příkladem geneticky podmíněného kryptorchidismu je cílená mutace Hoxa10 (homeobox transcription factor a10, transkripční faktor obsahující homeobox a10). Tato mutace však nebude pravděpodobně způsobovat nesyndromický (osamocený) kryptorchidismus, neboť je silně postižen samičí pohlavní systém a lumbální páteř, která je homeoticky transformována na morfologicky anteriorní obratle.
Teplota ve varlatech je nižší než teplota tělesného jádra. Dlouhodobá expozice nesestouplého varlete zvýšené teplotě je už dlouho považována za příčinu porušené spermatogeneze při kryptorchidismu. Časná chirurgická repozice (orchiopexe) vede totiž k normálnímu vývoji varlete, včetně plodnosti. Naopak, experimentálně navozený kryptorchidismus u hlodavců odhalil masivní apoptózu pachytenních spermatocytů jako mechanismus degenerace zárodečných buněk. Velmi podobné patologické změny byly nalezeny i u myší se zvýšenou expresí transgenního (lidského) proteinu Hsf1 (heat shock trasncription factor 1, transkripční faktor tepelného šoku), transkripčního regulátoru proteinů tepelného šoku. Lze tedy hypotetizovat, že Hsf1 funguje ve varlatech jako teplotní senzor, který vede spermatocyty, v kontrastu s jinými typy buněk, ke smrti v případě zvýšené teploty, aby se zabránilo geneticky poškozeným zárodečným buňkám dokončit spermatogenezi. Pachytén je období, kdy dochází ke crossing-overu, opravné mechanismy DNA jsou nezbytné pro bezchybné dokončení rekombinace a buňky mají vnitřní systém kontroly kvality, kdy buňky s poškozenou DNA hynou apoptózou. Zvýšená teplota může škodit zvýšením množství zlomů v DNA.
Obrázky
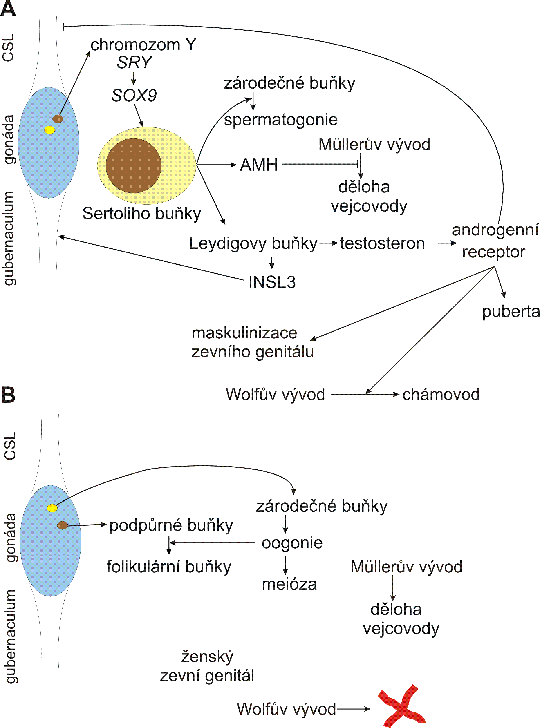
Obr. 3.1. Determinace pohlaví u mužů a žen
A: U mužů je gen Sry ležící na chromozomu Y exprimován v somatických buňkách (hnědá) a zvyšuje tak expresi genu Sox9 v těchže buňkách. Sox9 určí osud somatických buněk - stanou se z nich Sertoliho buňky. Sertoliho buňky pak 1) přepnou zárodečné buňky (žlutá) na program spermatogonií, 2) produkují AMH, který zničí Müllerův vývod a tak inhibuje vývoj dělohy a vaječníků a 3) indukují diferenciaci Leydigových buněk. Leydigovy buňky mají endokrinní aktivitu - produkují několik hormonů, některé s úzce specializovanou funkcí, jako Insl3 (insulin-like 3), který díky svému pravděpodobnému receptoru (Great) podporuje vývoj a kontrakci gubernákula. Hlavním produktem Leydigových buněk jsou steroidní hormony, hlavně testosteron, který působí prostřednictvím androgenního receptoru. Testosteron podporuje vývoj zevního genitálu, přetrvání Wolfova vývodu a vývoj v pubertě.
B: U žen se zárodečné buňky diferencují v oogonie, které rekrutují z okolí folikulární buňky a začínají se redukčně dělit. V nepřítomnosti testosteronu zaniká Wolfův vývod a vyvíjí se ženský zevní genitál. V nepřítomnosti AMH naopak pokračuje diferenciace Müllerova vývodu v dělohu a vejcovody.
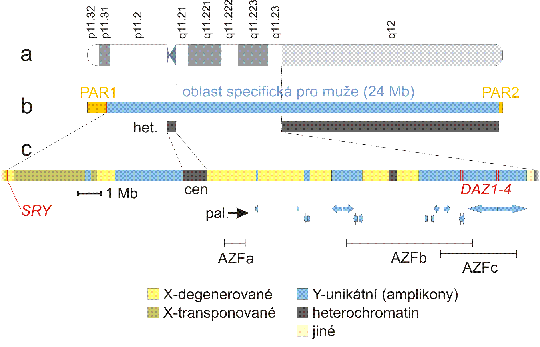
Obr. 3.2. Lidský chromozom Y
a: Chromozom Y je nejmenší z lidských chromozomů - délka typického chromozomu Y je odhadována asi na 57 Mb. Pouze asi polovina chromozomu ovšem obsahuje kódující sekvence, neboť chromozom Y obsahuje největší segment konstitutivního heterochromatinu, zahrnující skoro celý proužek q12. Tento segment heterochromatinu je navíc velmi variabilní v takovém rozsahu, že rozdílná délka proužku q12 může být detekována pomocí klasických cytogenetických postupů, např. pomocí G-pruhování.
b: pohlavní chromozomy se vyvinuly z původního páru homologních autosomů, s funkcí a obsahem genů podobným jako dnešní chromozom X. Evoluce chromozomu Y byla iniciována dvěma událostmi - získáním genu SRY determinujícího samčí pohlaví a potlačením rekombinace s chromozomem X v oblasti obsahující gen SRY (pravděpodobně v důsledku inverze nebo podobné přestavby). Potlačení rekombinace zahájilo diverzifikaci sekvencí obou chromozomů, tak se vyvtořila "oblast specifická pro muže" (male specific region, MSY), která později ztratila většinu genů. Tyto geny byly zachovány pouze na chromozomu X - mluvíme o chromozomu Y jako "chátrajícím" chromozomu X. Poškozený chromozom X může být totiž opraven s použitím homologního chromozomu, alespoň v samičích buňkách, ale chromozom Y žádného homologního partnera v euploidních buňkách nemá. Párování X a Y chromozomu je však nutné pro jejich správnou segregaci v meióze, a tak si chromozom Y spolu s MSY zachoval i dvě pseudoautozomální oblasti (pseudoautosomal regions) PAR1 a PAR2 v obou telomerických segmentech, které jsou identické s příslušnými telomerickými segmenty chromozomu X. Proto dědičnost genů lokalizovaných v PAR (asi 14 v PAR1, asi 3 v PAR2) sleduje model autosomální dědičnosti. het. = heterochromatin. Heterochromatinové oblasti lidských chromozomů zůstávají většinou nesekvenovány. Chromozom Y je zřejmě výjimka, neboť byla sekvenována všechna rozhraní euchromatin/heterochromatin a dokonce část jádra centromery. Soudí se, že heterochromatin je tvořen masivně amplifikovanými degererovanými tandemovými repeticemi o nízké komplexitě. Centromera chromozomu Y (cen) obsahuje repetici typu alfa satelitu, s primární jednotkou 171 bp a sekundární jednotkou 5941 bp a dále repetici typu GGAAT. Yq12 obsahuje repetice typu GGAAT a repetice o délce asi 3 kb bohaté na A a T.
c: oblast specifická pro muže (male specific region, MSY) je pestrou směsí různých tříd sekvencí - Degenerované sekvence z chromozomu X jsou homologické sekvencím na chromozomu X, ale homologie je pouze mírná. Stovky původních genů z chromozomu X byly ztraceny, 13 genů ztratilo funkci díky mutacím a staly se z nich pseudogeny. Zbylých 16 genů je exprimováno ve většině tkání, jsou nejspíš pod selekčním tlakem, aby zůstaly aktivní ve dvou kopiích i u mužů. Polymorfismus mezi kopií X a Y jednoho z těchto genů, genu pro protein zubní skloviny amelogenin se používá pro identifikaci pohlaví ve forenzním setu pro identifikaci osob na základě DNA (CODIS = Combined DNA Index System). Sekvence transponované z X se relativně nedávno translokovaly z chromozomu X, obsahují pouze 2 geny. Unikátní sekvence chromozomu Y se skládají z rozsáhlých invertovaných palindromů (pal.) a v menší míře tandemově opakovaných sekvencí (Yp11.2), dohromady nazývaných "amplikony", s cca 60 geny v mnoha téměř identických kopiích, které mohou být sdruženy do 9 rodin. Každá rodina je charakterizována >98% homologií na úrovni nukleotidů jak v exonech, tak v intronech. Tyto geny pocházejí z různých zdrojů: rodiny VCY a RBMY byly podobně jako degenerované X odvozeny ze společného předka X a Y chromozomu. families. Jiné geny, jako DAZ, byly získány na chromozom Y sérií transpozic z autosomů. Ještě jiným mechanismem se na Y dostala rodina CDY - retrotranspozicí a následnou amplifikací procesované mRNA z autosomálního genu. Většina těchto genů je téměř exkluzivně exprimována v zárodečných buňkách varlete. Na chromozomu Y se tedy akumulovaly geny nezbytné pro anebo zlepšující spermatogenezi. Jejich amplifikace do rodin zvyšuje pravděpodobnost udržení jejich funkce v oblasti bez crossing-overu, díky jinému typu homologní rekombinace, genové konverzi mezi jednotlivými členy rodiny.
Mutace nebo delece genu SRY vede k zvratu mužského na ženské pohlaví. Delece jiných částí chromozomu Y může být příčinou mužské neplodnosti s azoospermií. Existují 3 lokusy s rekurentními delecemi u azoospermických pacientů: AZFa, AZFb a AZFc. Delece AZFc je nejčastější, azoospermie je pravděpodobně způsobena chybějím všech genů DAZ (deleted in azoospermia). Produkt genu DAZ je protein vážící RNA, který je důležitý zejména pro funkci spermatogonií.
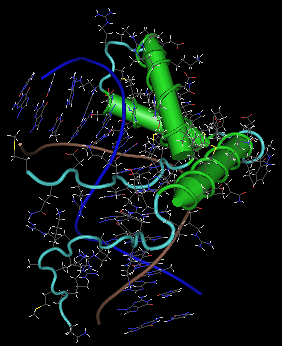
Obr. 3.3. Struktura proteinu SRY
Struktura proteinu SRY vázaného na malý žlábek specifického segmentu DNA. Páteř řetězců DNA jsou modře a hnědě. Proteinové alfa šroubovice jsou zeleně, kličky světle modře. Žádný beta list se v tomto proteinu nevyskytuje. Postranní řetězce DNA i proteinu mají barvu: C tmavě šedou, O červenou, N modrou, S žlutou a H bílou. Všimněte si výrazného ohybu DNA - ve spodní části má helix vertikální orientaci, ale díky interakci s proteinem se ohýbá v horní části směrem doleva. 3D strukturu lze získat z Protein Databank (PDB), z Entrez Structure (NCBI) nebo z jiných databází, pod přístupovým číslem 1J46 (odkazy přímo na strukturu v PDB: http://www.pdb.org/pdb/explore/explore.do?structureId=1J46, nebo v NCBI: http://www.ncbi.nlm.nih.gov/Structure/mmdb/mmdbsrv.cgi?form=6&db=t&Dopt=s&uid=17220). 2D snímek byl vytvořen programem Cn3D, volně dostupným z NCBI. Nicméně existují ještě mnohé další vizualizační nástroje, většinou také volně dostupné - k získání lepšího náhledu do struktury je záhodno vyzkoušet několik možností.